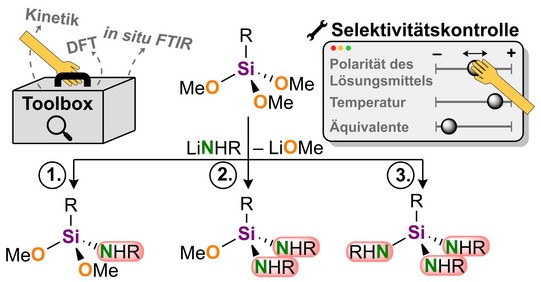
Unsere Veröffentlichung beschäftigt sich mit der gezielten funktionellen Umwandlung von Alkoxysilanen durch selektive Substitution von Methoxygruppen mit primären Lithiumamiden. Im Zentrum steht die mechanistische Aufklärung dieses Prozesses an molekularen Silanen, der eine kontrollierte Einführung von Aminfunktionen in Silanbausteine erlaubt. Als Ausgangsverbindungen wurden Methoxysilane verwendet, die im Vergleich zu industriell relevante Chlorsilane eine deutlich geringere Reaktivität zeigen und somit selektive Substitutionsprozesse am Siliciumzentrum ermöglichen.
Mittels einer Kombination aus in situ Fourier-Transform-Infrarotspektroskopie und quantenchemischen DFT-Berechnungen konnte der Verlauf der Monosubstitution detailliert untersucht werden. Dabei wurden sowohl die Reaktionsordnung als auch die Aktivierungsenergie bestimmt. Aufbauend auf diesen Erkenntnissen gelang es, gezielte Bedingungen für weiterführende Di- und Trisubstitutionen zu entwickeln. Die Selektivität der Substitution ließ sich gezielt über das Lösungsmittel steuern: Unter präparativ üblichen Bedingungen mit Mikrowellenbestrahlung führten Reaktionen in n-Heptan bevorzugt zur zweifachen Substitution, während in THF selektiv dreifachsubstituierte Produkte erhalten wurden.
Die Ergebnisse liefern einen mechanistischen Rahmen für die gezielte Entwicklung von Si–O- zu Si–N-Substitutionsstrategien mit synthetischer Relevanz. Die Arbeit steht damit in inhaltlichem Zusammenhang mit früheren Untersuchungen zur Reaktivität polarer funktioneller Gruppen am Silicium und erweitert diese nicht nur um neue synthesechemische Aspekte, sondern auch um kinetisch-mechanistische Schlüsselfaktoren.