Studie zeigt die Bedeutung einer atypischen intramolekularen Halogenbindung
- Neues aus der Fakultät 2018
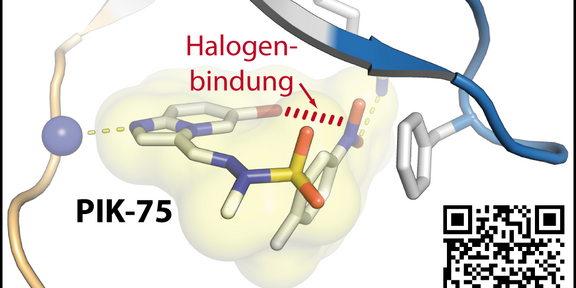
Die Arbeitsgruppe um Prof. Rauh beschreibt in einer neuen Arbeit die Struktur der Glykogensynthase-Kinase GSK-3β im Komplex mit dem potenten Inhibitor PIK-75. In enger Kooperation mit Kollegen aus Brasilien und BayerCrop Science fanden sie dabei eine zuvor nicht beobachtete atypische Art der Halogenbindung, die den Inhibitor in einer aktiven Konformation stabilisiert und die Bindung an das Enzym erleichtert.
Die Studie gibt somit neue Einblicke, wie kleine Moleküle durch das Einfrieren biologisch aktiver Konformationen in Zukunft noch gezielter optimiert werden können, um potente Wirkstoffe für die Behandlung von Erkrankungen zu erhalten. Die Ergebnisse wurden in der Angewandten Chemie publiziert (doi.org/10.1002/anie.201804917).
Tesch, R., Becker, C., Müller, M. P., Beck, M. E., Quambusch, L., Getlik, M., Lategahn, J., Uhlenbrock, N., Costa, F. N., Polêto, M. D., de Sena Murteira Pinheiro, P., Rodrigues, D. A., Sant'Anna, C. M., Ferreira, F. F., Verli, H., Fraga, C. A. M., and Rauh, D. (2018) An Unusual Intramolecular Halogen Bond guides Conformational Selection, Angew Chem Int Ed Engl. doi.org/10.1002/anie.201804917







