Proteincharakterisierung in lebenden Zellen mit ESR
- Neues aus der Fakultät 2021
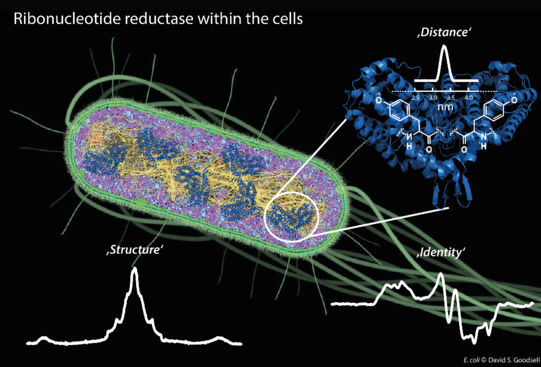
Proteine übernehmen lebenswichtige Aufgaben in jedem Organismus, weshalb die Aufklärung ihrer spezifischen Funktion und Struktur ein zentrales Thema der Forschung darstellt. Häufig werden dazu Experimente außerhalb der Zelle, also in vitro durchgeführt. Um jedoch die vollkommene Komplexität eines Organismus zu betrachten, sind Experimente an ganzen Zellen unabdingbar. Die Arbeitsgruppe von JProf. Müge Kasanmascheff untersuchte deshalb E. coli Bakterien mit der Elektronenspinresonanz (ESR) Spektroskopie und legte dabei den Focus auf das Protein Ribonukleotid-Reduktase.
Die Ribonukleotid-Reduktase spielt eine zentrale Rolle bei der Herstellung und Reparatur von DNA-Bausteinen und ist Gegenstand der Krebsforschung. Den Forschern geling es nun, dieses Protein in E. coli Zellen zu identifizieren und strukturelle Informationen aus in vitro Experimenten auf in vivo Bedingungen zu übertragen. Darüber hinaus konnten sie durch Distanzmessungen neue Erkenntnisse über das Protein in seiner natürlichen Umgebung erhalten, welche wertvolle Einblicke über die Proteinaktivität liefern können.
Die Arbeiten wurden im Rahmen des durch die Deutsche Forschungsgemeinschaft (DFG) geförderten Exzellenzclusters RESOLV durchgeführt und nun in einer als „Highy Important Paper“ ausgezeichneten open access Publikation in der Fach zeitschrift Angewandte Chemie veröffentlicht.
Original Publikation:
S. L. Meichsner, Y. Kutin, M. Kasanmascheff, “In‐Cell Characterization of the Stable Tyrosyl Radical in E. coli Ribonucleotide Reductase via Advanced EPR Spectroscopy” Angew. Chem. Int. Ed. (2021) DOI: 10.1002/anie.202102914.