Erfolgreiche Werkzeuge – kovalent-allosterische Inhibitoren zeigen Akt-Isoform-Selektivität
- Neues aus der Fakultät 2019
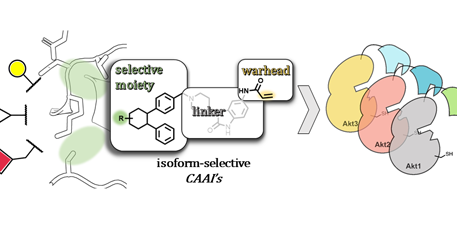
In der Arbeit präsentieren die Autoren, dass durch gezielte Einführung und Orientierung von kleinen Substituenten, an die pharmaklogisch vorteilhaften kovalent-allosterischen Inhibitoren, die Selektivität hinsichtlich der adressierten Akt-Isoformen beeinflusst werden kann. Ein detaillierter strukturbasierter Ansatz leitete Design und Entwicklung der Liganden hin zu idealen Eigenschaften, um die einzelnen hoch-konservierten Bindungstaschen dieser Kinasen selektiv zu adressieren. In Folgeexperimenten konnte die kovalente Modifikation mittels Massenspektrometrie für Akt1 und erstmalig für Akt2 bestätigt sowie biochemische und kinetische Eigenschaften in Aktivitätsassays ergründet werden. Anhand von Röntgen-Strukturanalyse konnten Proteinkristalle der Moleküle in Komplex mit Akt1 gelöst werden, welches zu neuen Einblicken der Bindungsmodi auf atomarer Ebene verhalf. Selbst in komplexen zellulären Systemen konnte ein Erhalt des Selektivitätsprofils dieser kovalent-allosterischen Liganden gezeigt werden.
Diese Ergebnisse können anregen, strukturelle Unterschiede in Isoformen und homologen Proteinen tiefgehender zu untersuchen, und verdeutlichen das Potenzial, welches letztlich in eine erfolgreiche Entwicklung von selektiven funktionellen Molekülen resultieren kann.
[1] Quambusch, L., Landel, I., Depta, L., Weisner, J., Uhlenbrock, N., Müller, M. P., Glanemann, F., Althoff, K., Siveke, J. T. and Rauh, D. (2019), Covalent‐Allosteric Inhibitors to Achieve Akt Isoform‐Selectivity. Angew. Chem. Int. Ed. Accepted Author Manuscript. doi:10.1002/anie.201909857.






