Archiv 2019
Dynamik auf der Mikrosekundenzeitskala im Wasserstoffbrückennetzwerk des aktiven Zentrums eines Enzyms
- Neues aus der Fakultät 2019
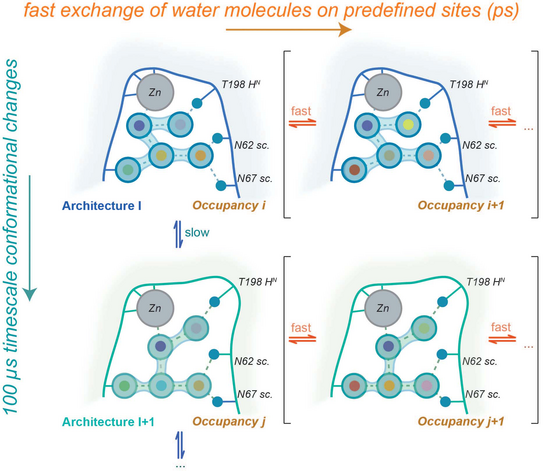
Dynamik im aktiven Zentrum von Enzymen ist repräsentiert eine wichtige Komponente ihrer Funktionalität. In vielen Enzymen bestehen zudem wohldefinierte Netzwerke von wasserstoffbrückenverknüpften Wassermolekülen, deren Aufenthaltsorte durch H-Brückendonoren und Akzeptoren auf der Proteinoberfläche definiert sind. Da die Verweilzeit dieser Moleküle am jeweiligen Orte allerdings kurz ist (ps), ist es nicht unbedingt intuitiv, dass eine Proteinbewegung auf der Microsekundenzeitskala sich auf das Wassernetzwerk auswirken kann. In ihrem kürzlich in der Zeitschrift Journal of the American Chemical Society erschienenen Artikel zeigen Linser und Kollegen mit Hilfe der protonendetektierten Festkörper-NMR-Spektroskopie, dass die definierten Gitterplätze des Wassers in der aktiven Tasche der humanen Carboanhydrase trotz des schnellen Platzwechsels der einzelnen Moleküle einer Dynamik unterworfen sind, die auf der 100 µs Zeitskala liegt und damit in den Bereich der für die Katalyse des Enzyms wichtigen Dynamik fällt.
So könnte die wechselnde Geometrie des Netzwerkes Bedeutung für den Austausch von Substrat/Produkt haben, insbesondere den kinetisch „schwierigen“ Schritt des Heraustransportes eines Protons aus der aktiven Tasche. Der Artikel, der aus dem Themenbereich des Dortmunder/Bochumer Exzellenzclusters RESOLV stammt, in dem die Gruppe Linser mitarbeitet, wird mit einer Covergraphik gefeatured.
Fast Microsecond Dynamics of the Protein–Water Network in the Active Site of Human Carbonic Anhydrase II Studied by Solid-State NMR Spectroscopy
H. Singh, S. K. Vasa, H. Jangra, P. Rovó, C. Päslack, C. K. Das, H. Zipse, L. V. Schäfer, R. Linser
J. Am. Chem. Soc. 2019, 141, 49, 19276-19288.







