Archiv 2018
Studie zeigt die Bedeutung einer atypischen intramolekularen Halogenbindung
- Neues aus der Fakultät 2018
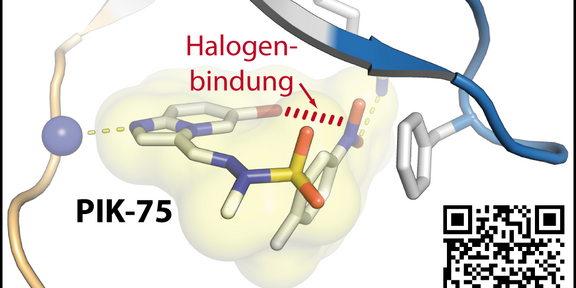
Die Studie gibt somit neue Einblicke, wie kleine Moleküle durch das Einfrieren biologisch aktiver Konformationen in Zukunft noch gezielter optimiert werden können, um potente Wirkstoffe für die Behandlung von Erkrankungen zu erhalten. Die Ergebnisse wurden in der Angewandten Chemie publiziert (doi.org/10.1002/anie.201804917).
Tesch, R., Becker, C., Müller, M. P., Beck, M. E., Quambusch, L., Getlik, M., Lategahn, J., Uhlenbrock, N., Costa, F. N., Polêto, M. D., de Sena Murteira Pinheiro, P., Rodrigues, D. A., Sant'Anna, C. M., Ferreira, F. F., Verli, H., Fraga, C. A. M., and Rauh, D. (2018) An Unusual Intramolecular Halogen Bond guides Conformational Selection, Angew Chem Int Ed Engl. doi.org/10.1002/anie.201804917







