Transiente strukturelle Eigenschaften des Rho-GDP-Dissoziationsinhibitors
- Neues aus der Fakultät 2024
Das Verständnis von Proteinen hat lange Zeit auf der Charakterisierung wohlgeordneter Strukturen gefußt; in den letzten Jahren hat sich aber eine wahre Revolution in der Strukturbiologie ereignet, die auf „ungeordnete“ Strukturen, sogenannte IDPs (intrinsich ungeordnete Proteine oder Regionen, IDRs) abzielt, die man sich als „Ensembles“ vornehmen und verstehen muss. Der ungeordnete Charakter ergibt sich aus großer struktureller Flexibilität mit kurzlebigen strukturellen Tendenzen, jedoch prägen auch diese den Zielproteinen im zeitlichen Mittel wohldefinierte und evolutionär konservierte Eigenschaften auf.
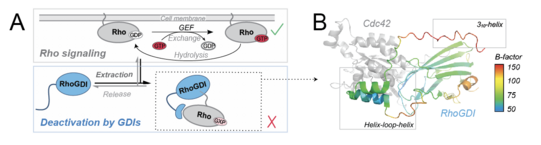
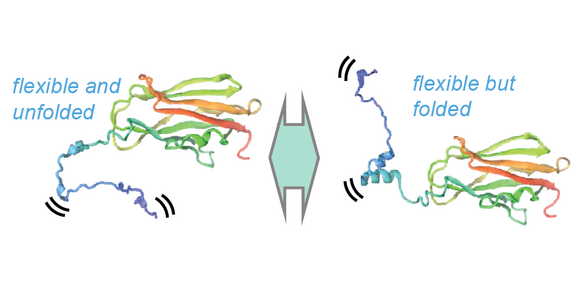
Die Aktivität von Rho-GTPasen, Hauptregulatoren einer Vielzahl zellulärer Prozesse, wird über Komplexbildung mit Guaninnukleotid-Dissoziationsinhibitoren (RhoGDIs) orchestriert. Man ging lange Zeit davon aus, dass diese einen völlig unstrukturierten N-Terminus besäßen, der bei Kontakt mit dem Klienten durch ein „Folding upon Binding“ in eine wohldefinierte Tertiärstruktur faltet und so dessen Nukleotidaustausch sterisch unterdrückt.
Sara Medina Gomez, Rasmus Linser und Kollegen, insbesondere die Gruppe von Peter Bieling am MPI Dortmund, haben dieses Modell als ein langjähriges Misskonzept entlarvt, indem sie die transienten strukturellen Eigenschaften des N-Terminus von RhoGDI 1 im Detail charakterisiert haben. Ihr vielschichtiger Ansatz, der Lösungs-NMR, Molekulardynamik-Simulationen und biochemische Assays kombiniert, zeigt, dass definierte strukturellen Eigenschaften bereits in Abwesenheit des GTPase-Klienten vorübergehend vorliegen und die Flexibilität des Terminus auch nach Bindung noch prägnant ist. Diese Ergebnisse revidieren das seit langem bestehende Lehrbuchbild zum Mechanismus der Membranextraktion von GTPasen.
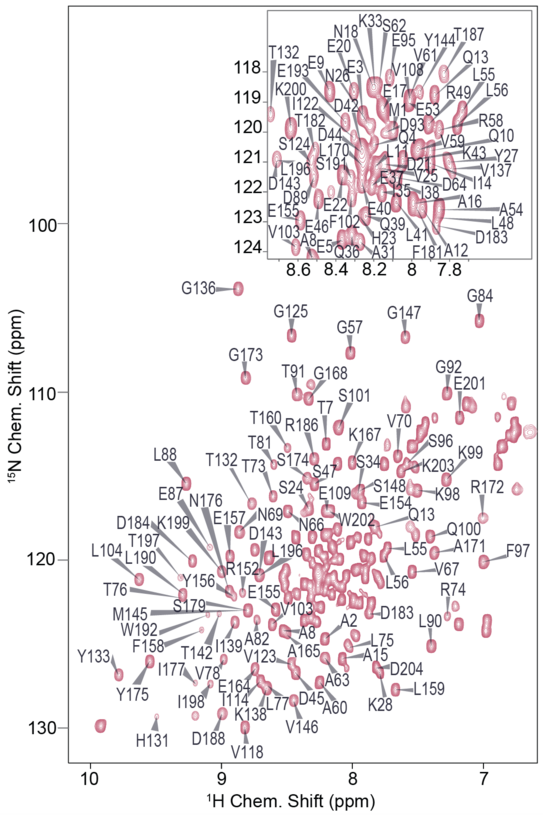
Molekulardynamik- (MD-)Simulationen zeigen, dass der N-Terminus ein großes Konformationsensemble durchfährt, während die Kerndomäne des Proteins gefaltet bleibt. Dabei wird eine Umwandlung zwischen vollständig entfalteten Konformationen und Zuständen, in denen N-terminale sekundäre Strukturelemente (insbesondere das Helix-Loop-Helix-Motiv und die N-terminale 310-Helix) spontan, auch ohne Bindung an den Bindungspartner, gebildet werden, ersichtlich. Um die ortsspezifischen strukturellen und dynamischen Eigenschaften zu charakterisieren, wurde dreidimensionale NMR-Spektroskopie verwendet, wobei verschiedene Proteinkonstrukte (RhoGDI in voller Länge und isolierte N-terminale Fragmente) eingesetzt wurden. Für alle Konstrukte wurde eine de novo Resonanzzuordnung durchgeführt und eine große Reihe von Experimenten eingebunden, um Informationen über Sekundärstruktur und Dynamik zu gewinnen. Diese Experimente zeigen das Vorhandensein von Sekundärstrukturelementen am N-Terminus auch ohne Komplexbildung mit dem GTPase-Klienten. Interessanterweise bleiben nicht nur diese Strukturen, sondern auch der flexible Charakter der Domäne sodann bei der Komplexbildung mit Cdc42 komplett erhalten, was dem altgedienten Bild des „Faltens durch Bindung“ völlig widerspricht.
Schließlich wurde die funktionale Bedeutung der internen strukturellen Stabilität biochemisch bewertet, indem ein Rest mutiert wurde, dessen Austausch sich auf die strukturelle Stabilität des temporären Helix-Schleifen-Helix-Strukturelements innerhalb des GDI-N-Terminus auswirken würde. Die Dissoziationsgeschwindigkeit wurde nun mithilfe eines auf Förster-Resonanzenergietransfer (FRET) basierenden Dissoziationsassays quantifiziert, wodurch gezeigt werden konnte, dass der Grad der Prästrukturierung für die hohe Affinität wichtig ist und somit die Bindungsstärke des dynamischen Ensembles erklärt.
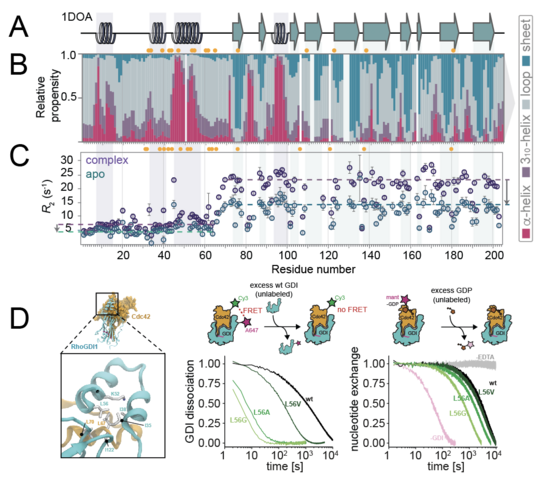
Die Studie zeigt, dass ein sterisches Blockieren der GTPase durch ihren Dissoziationsinhibitor mittels einer sich bei Assoziation faltenden Barriere nicht zutrifft. Mit seinen transienten strukturellen Eigenschaften scheint der Dissoziationsinhibitor vielmehr ein multifunktionales Element, das zwar auch die Bindungsaffinität zwischen GDI und GTPase erhöht, gleichzeitig aber als partiell vorgeformtes aber doch flexibles, externes Werkzeug fungieren kann, dessen lose angebundener Charakter z. B. beim Herauslösen des Klienten aus der Membran sicherlich besser dienlich ist als die starre Oberfläche eines globulären Proteins oder ein völlig ungeordneter Terminus gänzlich ohne Struktur.
Transient Structural Properties of the Rho GDP-Dissociation Inhibitor
Sara Medina Gomez, Ilaria Visco, Felipe Merino, Peter Bieling, Rasmus Linser
Angew. Chem. Int. Ed., 2024, DOI:10.1002/anie.202403941