Posterpreise für neue Ansätze in der computerunterstützten Wirkstoffforschung
- Neues aus der Fakultät 2015
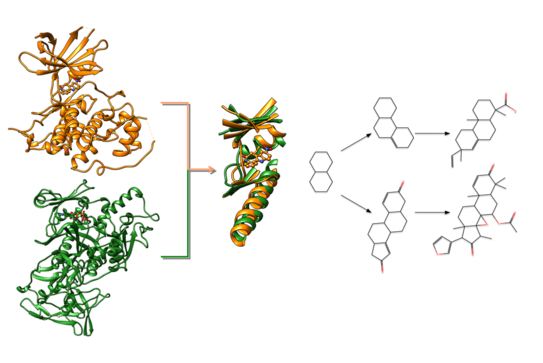
Die grundlegende Thematik beider Arbeiten handelt von der Ähnlichkeit von Proteinbindetaschen basierend auf ähnlichen Anordnungen von Sekundärstrukturelementen („Ligand Sensing Cores“) unabhängig vom gesamten Faltungsmuster. Erste Beispiele zeigen, dass ähnliche Ligand Sensing Cores ähnliche Molekül-Grundgerüste („Scaffolds“) binden können. Die Identifizierung dieser Ähnlichkeiten kann also einen erheblichen Einfluss auf das rationale Design von neuen Wirkstoffen haben, indem das Wissen über mögliche bindende Scaffolds auf ein neues Zielprotein übertragen werden kann.
Frau Ehrt hat ihre Arbeiten mit dem Titel „Repurposing of known kinase inhibitors for inhibition of trypanothione synthetase“ auf dem „29. Molecular Modelling Workshop“ in Erlangen. Sie hat dabei die Evaluierung und Anwendung einer neuen Methode vorgestellt, die aktuell von Tobias Brinkjost aus der AG Koch entwickelt wird. Mit Hilfe eines effizienten Graph basierenden Algorithmus ist es nun möglich, ähnliche Ligand Sensing Cores innerhalb der bekannten Proteinstrukturen zu identifizieren. Frau Ehrt versucht nun mit dieser Methode ähnliche Proteinbindetaschen zwischen der Trypanothionsynthetase und Kinasen zu identifizieren um auf diese Weise neue Anwendungsgebiete für bekannte Kinase-Inhibitoren zu erschließen. Die Trypanothionsynthetase ist ein neues Wirkstoffziel zur Bekämpfung von Trypanosomatid-Erkrankungen, wie z.B. der Schlafkrankheit. Die bereits erzielten hervorragenden Ergebnisse der engen Kooperation zwischen Christiane Ehrt und Tobias Brinkjost haben zur Verleihung des Posterpreises geführt.
Frau Humbeck versucht dagegen neue Ähnlichkeiten von Bindetaschen in unterschiedlichen Proteinen anhand der Aktivitätsdaten bekannter Inhibitoren zu identifizieren. Sie hat ihre Arbeiten mit dem Titel „Chemogenomics analysis of small molecule bioactivity data: Privileged scaffolds and conserved structural elements in proteins“ auf der „Frontiers in Medicinal Chemistry“ in Marburg vorgestellt. Datenbanken wie die Drugbank oder die ChEMBL enthalten die Aktivitätsdaten von Millionen unterschiedlichster Moleküle. Unter Zuhilfenahme verschiedenster Programme, die durch ein selbstgeschriebenes Programm angesteuert werden, ist es nun möglich diese Datenbanken nach Molekülgrundgerüsten zu durchsuchen, die an Proteine mit unterschiedlicher Funktion und unterschiedlichem Faltungsmuster binden. Die Information über die sogenannten „Privileged Scaffolds“ lassen sich für das rationale Wirkstoffdesign nutzen. Darüber hinaus konnte bereits ein weiteres Beispiel für ähnliche Ligand Sensing Cores in unterschiedlichen Proteinen identifiziert werden.






