Neue Technologie zur Synthese von Wirkstoffbibliotheken
- Neues aus der Fakultät 2022
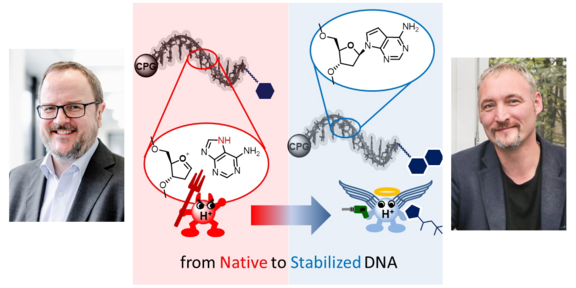
DNA-kodierte Molekülbibliotheken basieren auf chimären Molekülen, die einen kurzen DNA-Strang enthalten, welcher über einen Linker an ein kleines, arzneistoffartiges Molekül gekoppelt ist. Die Sequenz des DNA-Strangs dient dabei als Barcode für das Molekül. Da der DNA-Strang während des Syntheseprozess der kodierten Molekülbibliothek den Reaktionsbedingungen der Molekülsynthese ausgesetzt ist, können nur Synthesemethoden zum Einsatz kommen, die die Integrität der DNA nicht schädigen. In einer gemeinsamen Forschungsarbeit der Arbeitsgruppen Brunschweiger und Kast aus der Fakultät CCB und Bayer sollte eine chemisch stabilisierte DNA entwickelt werden, die funktional ist wie natürliche DNA, aber ein deutlich erweitertes Spektrum an Synthesebedingungen toleriert. Untermauert durch Berechnungen der Tautomerenpopulationen von vorgeschlagenen chemisch modifizierten Nucleobasen durch die Arbeitsgruppe Kast konnte die Arbeitsgruppe Brunschweiger ein Kodiersystem entwickeln, das es erlaubt, so modifizierte DNA für die kodierte Molekülsynthese zu nutzen. Biochemische Untersuchungen zeigten, dass die neu entwickelten DNA-Barcodes tatsächlich wie natürliche DNA an andere Barcodes ligiert werden konnten. Sie konnten durch DNA-Polymerasen in PCR-Experimenten vervielfältigt und s anschließend durch Sequenzanalyse ausgelesen werden. Untersuchungen zur chemischen Stabilität zeigten eine hervorragende Resistenz gegen auch sehr herausfordernde Reaktionsbedingungen und damit die Möglichkeit, eine Vielfalt an Molekülen herzustellen.






