Archiv 2021
Zelluläres Modellsystem ermöglicht die Entwicklung von neuartigen chemischen Werkzeugen
- Neues aus der Fakultät 2021
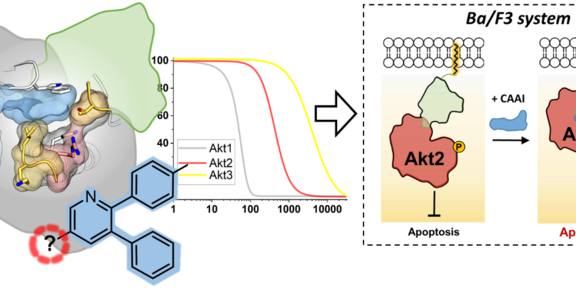
In dieser Publikation beschreibt die Forschungsgruppe ein neuartiges zelluläres Modellsystem auf der Grundlage von Akt-Isoform-abhängigen Ba/F3-Zelllinien, das die Bewertung innovativer Akt-Isoform-selektiver Inhibitoren in einem komplexen System ermöglicht. Kürzlich entwickelte Pyrazinon-basierte kovalent-allosterische Akt-Inhibitoren (engl. covalent-allosteric Akt inhibitors, CAAIs) (DOI: 10.1002/anie.201909857) inspirierten einen strukturgeleiteten Design-Ansatz, und in Kombination mit einer gründlichen Analyse der Akt-Isoform-Homologiemodelle wurde eine Reihe verschiedener und chemisch zugänglicher Pyridin-basierter CAAIs entworfen und synthetisiert. Zusätzliche Strukturdaten von zwei Akt1-Proteinkristallstrukturen im Komplex mit dieser innovativen Klasse von Inhibitoren, welche das Enzym irreversibel modifizieren und in einer inaktiven Form sperren, untermauern den Designansatz. Darüber hinaus wurden quantitative kinetische Messungen durchgeführt, um die synthetisierten Verbindungen hinsichtlich ihrer Bindungseigenschaften zu untersuchen. Die Kombination aus biochemischer Charakterisierung, Strukturdaten und dem hier neu entwickelten zellulären System ermöglichte es vielversprechenden Inhibitoren zu identifizieren. Diese Liganden eignen sich als sogenannte chemische Sonden für weitere Aufklärungsstudien und zeigten vielversprechende Ergebnisse in menschlichen Krebszellen.

Die Forschungsergebnisse berichtet das Team in der international angesehenen Fachzeitschrift Nature Communications. Gefördert wurde dieses Projekt u.a. vom Bundesministerium für Bildung und Forschung, dem Land Nordrhein-Westfalen (NRW), und der Europäischen Union (Europäischer Fonds für regionale Entwicklung: In Ihre Zukunft investieren) Drug Discovery Hub Dortmund (DDHD) und KomIT.
“Cellular model system to dissect the isoform-selectivity of Akt inhibitors”






