Neuer Ansatz gegen Parkinson: Protein-Chimäre macht Wirkstoff sichtbar
- Neues aus der Fakultät 2025

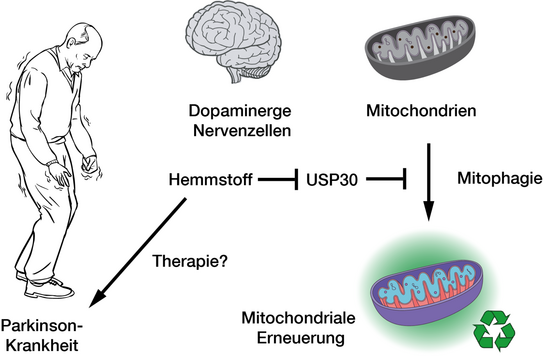
Die Funktionalität unseres Gehirns hängt maßgeblich von der Energieversorgung durch die zellulären Kraftwerke, die Mitochondrien, ab. Eine fehlerhafte Qualitätskontrolle dieser Organellen wird zunehmend mit dem Absterben von Nervenzellen und damit verbundenen Erkrankungen wie Parkinson in Verbindung gebracht. Insbesondere das Enzym USP30 aus der Gruppe der Deubiquitinasen spielt hierbei eine zentrale Rolle: Es entfernt Ubiquitin-Markierungen von geschädigten Mitochondrien und verhindert so deren Abbau durch Mitophagie. Ein vielversprechender Hemmstoff zur Blockade von USP30 wird derzeit in klinischen Studien untersucht, doch wie USP30-Inhibitoren auf molekularer Ebene wirken war bislang unklar. Die Forschungsgruppe um Malte Gersch hat diese Wissenslücke nun geschlossen – mithilfe von künstlich optimierte, chimären USP30-Varianten gelang es, die Struktur des Enzyms im Komplex mit einem Hemmstoff sichtbar zu machen.
Neue Perspektiven für therapeutische Ansätze bei Parkinson und anderen Krankheiten
Durch die gezielte Modifikation des Proteins konnte eine kristallisierbare Variante geschaffen werden, die detaillierte Einblicke in die Bindungsmechanismen des Hemmstoffs ermöglicht. Die Daten zeigen, dass der Hemmstoff auf zweierlei Weise mit USP30 interagiert: Er bindet zum einen an einen bisher unbekannten Bereich, der sich überhaupt erst durch die Interaktion mit dem Protein öffnet, und an einen Hotspot, der auch für andere Hemmstoffe zugänglich ist. Zugleich eröffnen sich durch den Einsatz chimärer Proteine neue Möglichkeiten zur Entschlüsselung krankheitsrelevanter Deubiquitinase-Strukturen und zur Entwicklung zielgerichteter Medikamente – ein vielversprechender Schritt hin zu Therapien gegen neurodegenerative und andere Krankheiten.
Original Publikation:
Kazi NH, Klink N, Gallant K, Kipka GM, Gersch M .
Chimeric deubiquitinase engineering reveals structural basis for specific inhibition of the mitophagy regulator USP30
Nat. Struct. Mol. Biol. 2025, doi: 10.1038/s41594-025-01534-4