α-Synuclein verändert die Konformation nicht-kanonischer DNA-Strukturen
- Neues aus der Fakultät 2020

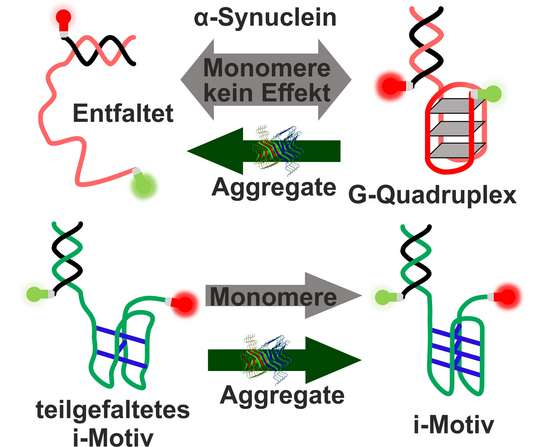
In einer neuen Studie unter der Leitung von Prof. Roland Winter konnte erstmals gezeigt werden, dass α-Synuclein auch die Konformation von G-Quadruplexen und i-Motiven beeinflusst. Diese Guanin- bzw. Cytosin-reichen nicht-kanonischen Nukleinsäurestrukturen kommen vor allem in den Telomeren und Promotorregionen der DNA vor und tragen damit zur epigenetischen Steuerung der Zellmaschinerie bei. Damit trägt die Arbeit ein weiteres Puzzlestück zum Verständnis der komplexen Ursachen neurodegenerativer Krankheiten bei und hilft somit bei der Entwicklung geeigneter Therapieansätze. Gefördert wurde das Projekt durch die Deutsche Forschungsgemeinschaft (DFG) im Rahmen des Exzellenzclusters RESOLV. Die Arbeit wurde im renommierten Journal of the American Chemical Society veröffentlicht.
Original-Publikation:
”Remodeling of the Conformational Dynamics of Noncanonical DNA Structures by Monomeric and Aggregated α‑Synuclein”
J.-M. Knop, S. K. Mukherjee, R. Oliva, S. Möbitz, R. Winter,
J. Am. Chem. Soc. 2020, 142, 18299−18303, DOI: 10.1021/jacs.0c07192





