Archiv 2022
Unbekanntes Signal eines Radikals bei der [FeFe]-Hydrogenase CbA5H
- Neues aus der Fakultät 2022
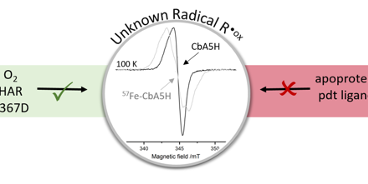
Hydrogenasen sind Enzyme, die in Mikroorganismen weit verbreitet sind und die Produktion und Nutzung von molekularem Wasserstoff katalysieren. Diese Reaktion findet am aktiven Metallzentrum statt, dem sogenannten H-Cluster, das durch Sauerstoff rapide zerstört wird. Eine sauerstoff-resistente Ausnahme stellt die [FeFe]-Hydrogenase von Clostridium beijerinckii (CbA5H) dar, die reversibel einen vor Sauerstoff geschützten Zustand einnehmen kann. Das Team um JProf. Müge Kasanmascheff setzte nun die Elektronenspinresonanz-Spektroskopie ein, um das aktive Zentrum von CbA5H genauer zu untersuchen.
Neben bereits bekannten H-Cluster-Zuständen entdeckten die Wissenschaftler*innen ein unbekanntes Radikalsignal, welches sie R•ox nannten. Es unterscheidet sich in seinen Eigenschaften von typischen organischen Radikalen und bekannten H-Cluster-Zuständen. R•ox ist hauptsächlich im oxidierten Enzym zu finden und wird nur in Anwesenheit des intakten H-Clusters und Protonentransferpfads gebildet. Mithilfe von selektiver 57Fe-Anreicherung gelang es dem Team, R•ox am oder in der Nähe des H‑Clusters zu lokalisieren. Diese Ergebnisse wurden kürzlich in der renommierten Fachzeitschrift Chemical Science veröffentlicht. Die Arbeiten wurden im Rahmen des durch die Deutsche Forschungsgemeinschaft (DFG) geförderten Exzellenzclusters RESOLV durchgeführt.
Original-Veröffentlichung:
The oxygen-resistant FeFe-hydrogenase CbA5H harbors an unknown radical signal





