Neue Enzymaktivitäten im Ubiquitin-System entdeckt
- Neues aus der Fakultät 2024
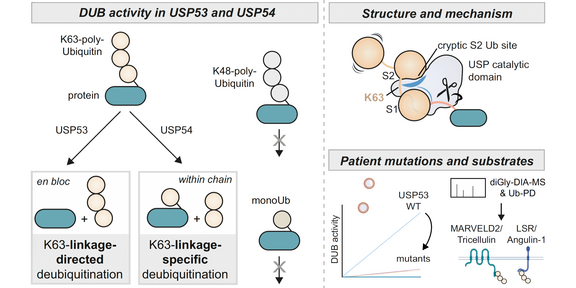
Den Autoren gelang es mit chemischen Sonden und der proteinchemischen Synthese von Substraten in beiden Proteinen eine hohe Spezifität für über K63-verknüpfte Polyubiquitin-Ketten zu identifizieren. Weitere Experimente zeigten, dass USP54 innerhalb dieser Ketten schneidet mit einer Präferenz für längere Ketten, wohingegen USP53 Substratproteine "en bloc" deubiquitinieren kann - die Ubiquitin-Kette quasi komplett entfernt, sofern die Ubiquitin-Einheiten darin über das Lysin 63 verknüpft sind. Die Mechanismen dieser neuartigen Aktivitäten konnten durch biochemische und strukturelle Analysen aufgeklärt werden. Eine Schlüsselrolle nimmt darin eine kryptische, zweite Ubiquitin-Bindungsstellen innerhalb ihrer katalytischen Domänen ein. In Zusammenarbeit mit dem Labor von Jeroen Demmers der Erasmus-Universität Rotterdam gelang es nachfolgend, Substrate von USP53 zu identifizieren, die auf den Mechanismus der USP53-vermittelten Krankheitsentstehung hindeuten und damit die neuartige Aktivität auch im zelluläre Kontext zu validieren.





