Entschlüsselung von Solvatationseffekten auf die integrative Selbstsortierung von Koordinationskäfigen
- Neues aus der Fakultät 2024
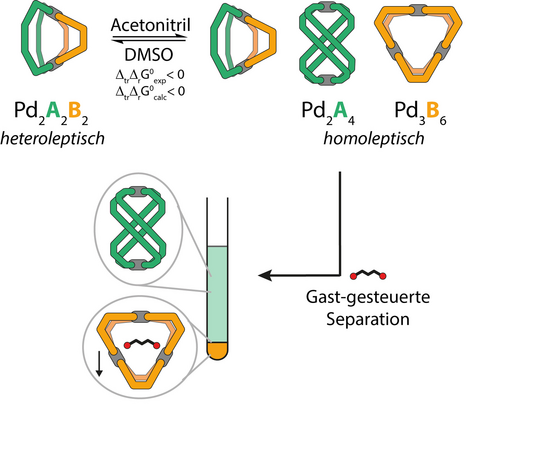
Eine Klasse von Wirtsmolekülen, sogenannte Koordinationskäfige, können durch Kombination von mit Donoreinheiten ausgestatteten organischen Molekülen („Liganden“) und Metallionen wie Palladium(II) erhalten werden. Aufgrund ihrer nanometergroßen Kavitäten sind die Verbindungen interessant für die Katalyse, die Sensorik und die molekulare Separation. Mit dem Ziel die Funktionalität dieser Systeme zu steigern, hat sich die Gruppe von Prof. Dr. Guido Clever auf die Bildung von heteroleptischen Käfigen, welche aus mehr als einer Sorte Ligand bestehen, spezialisiert. Aufgrund der hohen Anzahl an möglichen Anordnungen der Liganden in der finalen Struktur ist der Erhalt einer definierten Spezies herausfordernd. Die bisher entwickelten Strategien sind auf das gezielte Design der Ligandenstruktur fokussiert. Allerdings wird beobachtet, dass die Selbstassemblierung durch weitere Faktoren wie das Lösungsmittel beeinflusst wird. Diese Solvatationseffekte sind quantitativ schwer zu erfassen, was eine Vorhersage der Selektivität allein auf Basis der Ligandenstrukturen verhindert.
Die beiden Arbeitsgruppen haben nun eines dieser lösungsmittelabhängigen Systeme genauer untersucht (Abbildung): Die Gruppe von Prof. Clever fand, dass in DMSO als Lösungsmittel ausschließlich der heteroleptische Käfig vorliegt, während in Acetonitril eine Mischung der drei Komponenten erhalten wird. Vollständige Separation in die homoleptischen Assemblierungen wird durch die Zugabe eines geeigneten Gastmoleküls ermöglicht. Die lösungsmittelabhängige Gleichgewichtskonstante konnte von experimenteller Seite nur für Acetonitril einschließlich einer Aufspaltung in entropische und enthalpische Terme gemessen werden; für DMSO war dies quantitativ nicht möglich.
Um das vollständige Bild zu erfassen und einen tieferen Einblick in die Rolle des Lösungsmittels zu erlangen, hat die Gruppe von Prof. Dr. Kast spezielle Methoden entwickelt, um sämtliche thermodynamischen Terme in beiden Lösungsmitteln zu berechnen, einschließlich elektronischer Polarisationseffekt aufgrund der Solvatation und der Visualisierung der Verteilung der Lösungsmittelpartikel. Hiermit konnte gezeigt werden, dass der heteroleptische Käfig in der Gasphase bevorzugt ist, die homoleptischen Spezies aber durch Lösungsmitteleffekte stabilisiert werden. Die Ergebnisse deuten darauf hin, dass der Grund für die lösungsmittelabhängige Separation in der unterschiedlichen Größe der beiden Solvensmoleküle liegt: Es passen mehr der kleineren Acetonitril-Moleküle verglichen mit DMSO in die enge Kavitäten, was sich quantitativ an den Solvatationsentropien als hauptsächliche thermodynamische Triebkraft ablesen lässt.
Die Arbeiten wurden im Rahmen der Exzellenzstrategie RESOLV (www.solvation.de) durchgeführt und finanziert. Hierbei handelt es sich um eine interdisziplinäre Kooperation zwischen mehreren Forschungseinrichtungen im Ruhrgebiet, welche das Ziel verfolgt, das Verständnis der Rolle des Lösungsmittels in chemischen Reaktionen zu verbessern. Finanzierung erfolgte weiterhin durch das Graduiertenkolleg GRK2376 (www.confinement-controlled-chemistry.de).
Autoren: Laura Neukirch, Stefan Kast, Guido Clever