Archiv
Ein Sonden-Paar zur spezifischen Inhibition der Deubiquitinase UCHL1 in Zellen
- Neues aus der Fakultät 2022
Eine Vielzahl zellulärer Vorgänge wie der Abbau oder Transport von Proteinen wird durch die reversible Modifikation mit dem Protein Ubiquitin reguliert. Diese Modifikation wird enzymatisch von Deubiquitinasen (DUBs) umgekehrt. Inaktivierende Mutationen in der DUB UCHL1 führen in Menschen zu neurodegenerativen Erkrankungen, allerdings wurde eine erhöhte Enzymmenge auch in zahlreichen Krebsarten identifiziert, wo diese die Metastasierung unterstützt.
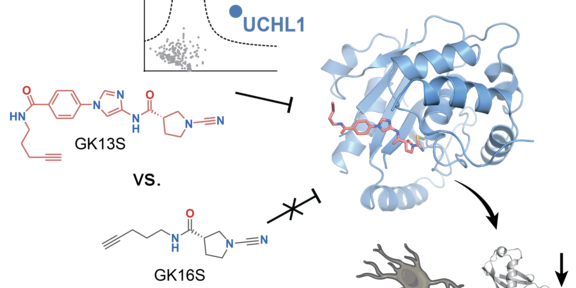
Um die molekulare Rolle von UCHL1 mit chemischen Inhibitoren zu untersuchen, synthetisierten Christian Grethe und Mirko Schmidt aus der Arbeitsgruppe Gersch eine Bibliothek möglicher DUB-Sonden, aus denen das Paar GK13S und GK16S aus der Gruppe der Cyano-Pyrrolidine hervorging. UCHL1 bindet nur GK13S, während die Minimalsonde GK16S auch weitere ebenfalls von GK13S gebundenen Proteine bindet, so dass sich dieses Sonden-Paar zur spezifischen Untersuchung der Rolle von UCHL1 in Zellen eignet. Damit gelang es, die Reduktion von freiem Ubiquitin aufgrund von UCHL1-Inhibition in einer Gliazellkultur nachzustellen. Dieser Effekt deckt sich mit Daten aus dem Gehirn von UCHL1-Mausmodellen, und untestützt die These, dass die in Patienten beobachteten Mutationen im UCHL1-Gen zu einer globalen Störung des Ubiquitin-Systems mit verminderten Mengen an freiem Ubiquitin führt.
Den Autoren gelang es weiterhin, die Struktur von UCHL1 im Komplex mit der Sonde GK13S zu lösen. Überraschenderweise zeigte das Enzym eine Hybrid-Konformation, in der einzelne Aminosäuren die gleiche Anordung wie im freien Zustand und andere Aminosäuren die Anordnung aus dem Substrat-gebundenden Zustand zeigten. Auf dieser konformationellen Plastizität beruht die hochspezifische UCHL1-Inhibition gegenüber allen anderen Deubiquitinasen. Außerdem deutet die Struktur an, wie und wo auch andere Klassen von Deubiquitinasen durch Liganden gebunden werden könnten. Das in der Publikation vorgestellte Sonden-Paar wird es ermöglichen, die molekulare Rolle dieses vielfach als „enigmatisch“ beschriebenen Enzymes des Ubiquitin-Systems zu erforschen und weiterentwickelte Inhibitoren auf ihre Tauglichkeit als mögliche Krebsmedikamente zu untersuchen.
Original-Veröffentlichung: Nature Communications





