Archiv
Echtzeit-Kontrolle der Dynamik eines Signalnetzwerks mit Licht
- Neues aus der Fakultät 2020

Einzelne Zellen generieren sehr dynamische Kontraktionen, wodurch sie ständig ihre Form ändern, wie zum Beispiel in der Embryonalentwicklung oder der Tumorprogression. In einer aktuellen Publikation der renommierten Fachzeitschrift Cell Reports kombiniert ein internationales Forscherteam unter der Leitung von Leif Dehmelt experimentelle und theoretische Ansätze, um diese komplexen Prozesse besser zu verstehen.
In der neuen Studie setzt die Dehmelt Gruppe Mikroskopie-basierte, Licht-schaltbare Störungsmethoden ein, um ein Signalnetzwerk, welches die Zellkontraktion steuert, gezielt und akut in einzelnen, lebenden Zellen zu manipulieren. Gleichzeitig wurde die dynamische Antwort dieses Signalnetzwerks gemessen, um Rückschlüsse auf die Signalverarbeitung in Zellen zu ermöglichen. Basierend auf diesen Ergebnissen wurde ein theoretisches Modell erstellt, welches die Komponenten und Interaktionen des Signalnetzwerks quantitativ beschreibt. Ein zentraler Aspekt dieses Netzwerks sind positive und negative Rückkopplungs-Schleifen, welche hoch-dynamische Zellkontraktions-Pulse generieren, die in zahlreichen physiologischen Prozessen beobachtet werden. Das theoretische Modell ermöglichte Vorhersagen, wie die Dynamik dieses Signalnetzwerks auf gezielte Störungen der Rückkopplungs-Schleifen reagiert. Mithilfe einer licht-basierten Fein-Abstimmung des Signalnetzwerks in einzelnen lebenden Zellen konnten diese Vorhersagen bestätigt werden. Durch diese Technik, welche als „Optogenetic Tuning“ bezeichnet wird, hat die Dehmelt Gruppe entdeckt, dass das Signalnetzwerk besonders intensive Kontraktionspulse bei mittleren Konzentrationen des Signalproteins GEF-H1 generiert. Solche Pulse spielen insbesondere in der Embryonalentwicklung eine wichtige Rolle. Die Sensitivität des Signalnetzwerks, um mechanische und biochemische Signale zu verarbeiten ist hingegen bei niedrigen Konzentrationen dieses Signalproteins maximal. Dieser Prozess, welcher als Mechanotransduktion bezeichnet wird, spielt zum Beispiel im Tumorwachstum eine wichtige Rolle. Die neuen theoretischen und experimentellen Erkenntnisse der Dehmelt Gruppe bilden die Grundlage um auch komplexere Prozesse in der Embryonalentwicklung und der Tumorentstehung besser zu verstehen.
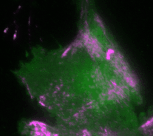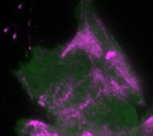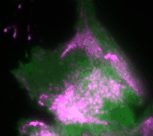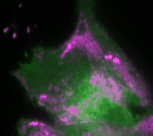
Regelmäßige Pulse des Zellkontraktionsregulators Rho (grün) und zeitlich verzögerte Pulse des Motorproteins Myosin (magenta), welches kontraktile Kräfte generieren kann
Publikation:
Kamps et al.,
Optogenetic Tuning Reveals Rho Amplification-Dependent Dynamics of a Cell Contraction Signal Network.
Cell Reports 33:108467 (2020)
DOI





