Konformationelle Dynamik eines proteingebundenen Liganden auf der Mikrosekunden-Zeitskala
- Neues aus der Fakultät 2024

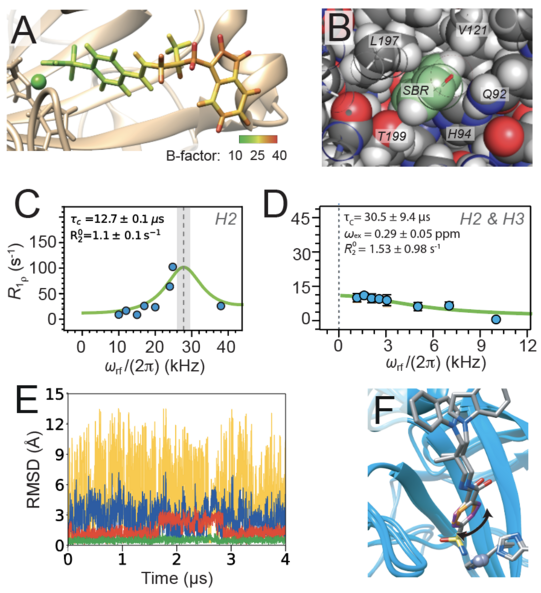
In der Zeitschrift Angewandte Chemie beschreibt die Gruppe um Prof. Rasmus Linser die interne Dynamik eines an das Protein Carboanhydrase hCAII gebundenen Inhibitors. Julia Kotschy, Benedikt Söldner und ihre Kollegen konnten mittels Kernmagnetresonanzspektroskopie experimentell nachweisen, dass sowohl in Lösung als auch im Festkörper ein rotamerer Austausch des Liganden auf der für solche kleinen Moleküle ungewöhnlich langsamen Mikrosekunden-Zeitskala stattfindet.
Die Erfassung der Dynamik von an Proteinen gebundenen kleinen Molekülen ist vor allem im Mikrosekundenbereich interessant, weil die Daten auf dieser für die Enzymkatalyse wichtigen Zeitskala für das Design neuer Wirkstoffe in der medizinischen Chemie oder zum besseren Verständnis von Substratselektivität und Reaktionsgeschwindigkeiten nützlich sein könnten. Röntgenkristallographie und Kryoelektronenmikroskopie von Proteinkomplexen können zwar detaillierte Auskunft über intermolekulare Wechselwirkungen geben, Bewegungen und vor allem der Austausch zwischen symmetrischen Konformationen ist jedoch schwer nachweisbar.
NMR-Spektroskopie generell ermöglicht die Messung von Dynamiken sowohl im schnellen Pico- bis Nanosekundenbereich als auch auf der langsameren Mikro- bis Millisekunden-Zeitskala, die im Hinblick auf Enzymkatalyse und Interaktionen in Signalkaskaden ein Hauptfokus der Strukturbiologie von Proteinen sind. Durch 1H Bloch-McConnell Relaxationsdispersion (BMRD) in Lösung und
1H R1ρ Relaxationsdispersion (NERRD) im Festkörper (an mikrokristallinem Enzym-Inhibitor-Komplex) konnte die Gruppe um Prof. Rasmus Linser nun nachweisen, dass sich der Benzolring des mit hoher Affinität an das Enzym humane Carboanhydrase II (hCAII) gebundenen Liganden auf der Mikrosekundenzeitskala bewegt. Mittels Molecular Dynamics Simulationen klären die Autoren die experimentell beobachtete Bewegung mechanistisch auf und zeigen, dass es sich bei der gemessenen µs-Dynamik um rotamere Sprünge des im Liganden enthaltenen, sterisch eingeschränkten Benzolrings um 180° handelt.